EMA empfiehlt Antikörper Lecanemab zur Verlangsamung von Alzheimer-Symptomen. Einschränkungen bei Genkopien und Nebenwirkungen beachten.
Neue Alzheimer-Therapie zugelassen: Hoffnung für Betroffene
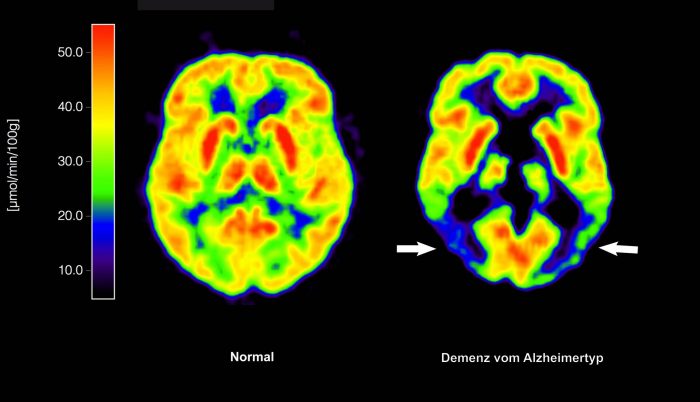
In Deutschland sind etwa eine Million Menschen von Alzheimer betroffen. Die Europäische Arzneimittel-Agentur EMA hat der EU erstmals grünes Licht für eine Alzheimer-Therapie gegeben, die auf zugrundeliegende Krankheitsprozesse abzielt. Sie empfiehlt die Zulassung des Antikörpers Lecanemab zur Behandlung von leichter kognitiver Beeinträchtigung (Gedächtnis- und Denkstörungen) oder leichter Demenz in einem frühen Stadium der Alzheimer-Krankheit.
Warum ist die Entscheidung so besonders?
Bislang haben die bisherigen Alzheimer-Therapien nur die Symptome der Krankheit behandelt, nicht jedoch die zugrunde liegenden Prozesse im Gehirn. Im Falle von Lecanemab ist dies anders: Der Antikörper zielt auf Amyloid-Ablagerungen im Gehirn ab und soll dadurch den Krankheitsverlauf verlangsamen. Allerdings strebt auch dieser Wirkstoff weder Heilung noch Verbesserung an, ein solches Mittel ist weiterhin nicht in Sicht.
Der Hauptmaßstab für die Wirksamkeit war die Veränderung der kognitiven und funktionellen Symptome nach 18 Monaten, die anhand einer Demenzbewertungsskala gemessen wurde. Die Skala reicht von 0 bis 18, wobei höhere Punktzahlen eine stärkere Beeinträchtigung anzeigen. Mit Lecanemab behandelte Patienten wiesen nach 18 Monaten im Durchschnitt einen etwas geringeren Anstieg des Wertes auf (1,22 gegenüber 1,75). Das deute auf einen langsameren kognitiven Abbau hin, teilte die EMA mit.
Warum können nicht alle Alzheimer-Patienten Lecanemab bekommen?
Die Amyloid-Plaques haben bereits irreversible Schäden im Gehirn verursacht, daher ist ihre Entfernung nutzlos. Laut Johannes Levin vom Deutschen Zentrum für Neurodegenerative Erkrankungen (DZNE) werden die ersten drei Jahre als frühe Phase von Alzheimer angesehen. Dies betrifft derzeit wahrscheinlich mindestens 250.000 Menschen in Deutschland. In dieser Frühphase kann der Betroffene noch gut alleine zurechtkommen, bemerkt jedoch zunehmend, dass sein Gedächtnis nachlässt.
Bei der EMA-Empfehlung gibt es jedoch eine zusätzliche Einschränkung: Das Medikament sollte nur bei Alzheimer-Patienten angewendet werden, die entweder eine oder keine Kopie von ApoE4, einer spezifischen Form des Gens für das Protein Apolipoprotein E, haben. Bei diesen Patienten ist das Risiko für bestimmte schwerwiegende Nebenwirkungen – Gehirnschwellungen und Blutungen – geringer als bei Personen mit zwei ApoE4-Kopien.
Laut Gabor Petzold, Direktor der Klinischen Forschung am DZNE, stellen Menschen mit einer oder keiner ApoE4-Kopie je nach Region etwa zwei Drittel bis 80 Prozent der Alzheimer-Patienten dar. In Deutschland beträgt dieser Anteil ungefähr 80 Prozent.
Experten zufolge sind nur wenige Alzheimer-Erkrankte für eine Antikörpertherapie geeignet, da weitere einschränkende Voraussetzungen hinzukommen.
Geht es jetzt direkt los mit solchen Behandlungen?
„Nein. Es ist zu beachten, dass noch einige Schritte bis zum Einsatz in Deutschland erforderlich sind“, sagte Petzold. „Die Zulassung durch die EU-Kommission steht noch aus, und der Hersteller wurde unter anderem verpflichtet, umfassende Handreichungen und Schulungen für Ärzte zu erstellen und ein Beobachtungsregister einzurichten.“
Es wird noch einige Monate dauern, bis das Mittel tatsächlich verwendet werden kann. Bei Patienten muss Alzheimer wiederum erst durch Biomarker-Tests nachgewiesen werden, gefolgt von einem genetischen Test. Die Therapie kommt zudem wirklich nur für Betroffene mit einer Vorstufe oder einem sehr frühen Stadium der Erkrankung in Frage.
In den kommenden Tagen sei jedoch bereits mit einer Vielzahl von Anfragen von Betroffenen und deren Angehörigen bei Hausärzten, Alzheimer-Zentren und Gedächtnissprechstunden zu rechnen, sagte Petzold. Levin befürchtet einen Ansturm von Zehntausenden Menschen bereits bei geringfügigen Vergesslichkeiten. Eine solche Flut von Abklärungen wäre für die Diagnosezentren kaum zu bewältigen, sagte er.
Der Neurologe Özgür Onur von der Uniklinik Köln geht zudem davon aus, dass er nur verhältnismäßig wenig Erkrankte pro Jahr mit der neuen Therapie behandeln kann, da die häufigen Gaben eine große Herausforderung darstellen. «Ich gehe bei uns in Köln von 50 bis 100 Patienten aus, die wir pro Jahr behandeln können. Und wir sind ein großes Zentrum.»
Hatte die EMA Lecanemab nicht eigentlich schon abgelehnt?
Ja, im Juli hat die Europäische Arzneimittelbehörde festgestellt, dass das Risiko schwerwiegender Nebenwirkungen des Antikörpers höher einzuschätzen ist als die erwartete positive Wirkung. Daraufhin hat das Unternehmen Eisai eine erneute Überprüfung beantragt.
Der Humanarzneimittelausschuss (CHMP) der EMA hat nun festgestellt, dass in der begrenzten Population, die bei der erneuten Prüfung untersucht wurde, der Nutzen von Lecanemab bei der Verlangsamung des Fortschreitens der Krankheitssymptome größer ist als die Risiken. In der ersten Prüfung wurden noch keine Untergruppenanalysen durchgeführt, sondern alle Patienten wurden einbezogen.
Die EU-Kommission, die für die Zulassung verantwortlich ist, folgt in der Regel dem Votum der Behörde. Die Hersteller von Lecanemab sind die Pharmaunternehmen Eisai (Japan) und Biogen (USA).
Warum der Bezug auf eine Untergruppe?
Die EMA berichtete, dass bei den Patienten, die mit Lecanemab behandelt wurden und nur eine oder keine ApoE4-Kopie hatten, Ödeme im Gehirn bei 8,9 Prozent auftraten, im Durchschnitt aller Patienten jedoch bei 12,6 Prozent. Mikroblutungen wurden bei 12,9 Prozent der Patienten mit nur einer oder keiner ApoE4-Kopie festgestellt, im Vergleich zu 16,9 Prozent in der allgemeinen Population. Bei den Patienten mit nur einer oder keiner ApoE4-Kopie, die mit Placebo behandelt wurden, waren die Raten für Schwellungen bei 1,3 Prozent und für Blutungen bei 6,8 Prozent, wie von der EMA angegeben.
Wie gefährlich sind solche Ödeme und Mikroblutungen?
Die festgestellten Schwellungen und Mikroblutungen im Gehirn verliefen größtenteils symptomlos und wurden meist erst durch bildgebende Verfahren wie Magnetresonanztomographie (MRT) entdeckt. Bei wiederholtem Auftreten besteht jedoch die Gefahr einer verminderten Gehirnleistung oder Koordinationsproblemen. Mikroblutungen gelten auch als Risikofaktor für größere, potenziell lebensbedrohliche Hirnblutungen.
Die EMA hebt in ihrer Stellungnahme hervor, dass es unbedingt Maßnahmen zur Risikominimierung geben muss. Vor Beginn der Behandlung und vor der 5., 7. und 14. Lecanemab-Dosis müssen bei den Patienten daher MRT-Scans durchgeführt werden, zusätzliche Scans bei Warnzeichen wie Kopfschmerzen, Sehstörungen und Schwindel. Die Behandlung selbst ist ebenfalls aufwendig: Lecanemab wird alle zwei Wochen als intravenöse Infusion verabreicht.
Ist Lecanemab das einzige ursächlich wirkende Mittel?
Nein. Die EMA hat Ende 2021 die Zulassung des Antikörpers Aducanumab, entwickelt von Biogen, nicht empfohlen: Der angebliche klinische Effekt des Medikaments ist fraglich. Eli Lilly hat einen weiteren Zulassungsantrag für den Wirkstoff Donanemab gestellt. Dieser Prozess ist noch nicht abgeschlossen.
Die US-Arzneimittelbehörde FDA hat Aducanumab im Jahr 2021 für die Alzheimer-Therapie zugelassen, aber Biogen hat die Produktion Anfang des Jahres wieder eingestellt. Anfang 2023 wurde Lecanemab in den USA eingeführt. Donanemab wurde von der FDA am 2. Juli dieses Jahres zugelassen. Alle drei Antikörper haben einen ähnlichen Wirkmechanismus.
Gibt es Bedenken?
Im Fachjournal «The BMJ» äußerten Experten kürzlich Kritik an den FDA-Entscheidungen. Die Medikamente zeigten nur eine unmerkliche Verlangsamung der Demenz, dagegen jedoch schwerwiegende unerwünschte Nebenwirkungen, den Tod eingeschlossen, heißt es. Fragwürdig seien auch die finanziellen Verbindungen von Mitgliedern des FDA-Beratungsausschusses zu Pharma-Konzernen.
Kritik gibt es in «The BMJ» auch an den Aussagen der Hersteller, das Fortschreiten der Alzheimer-Krankheit werde deutlich verlangsamt – im Vergleich zu einer Placebotherapie je nach Teilgruppe um bis zu 35 Prozent. «Das ist eine irreführende Aussage», wird der Neurologe Alberto Espay von der Universität von Cincinnati speziell zu den Donanemab-Daten zitiert. «Das ist ein relativer Unterschied, der einen sehr kleinen absoluten Unterschied in eine Zahl verwandelt, die beeindruckend erscheint.»
Fraglich ist, wie alltagsrelevant die messbare leichte Verzögerung des Krankheitsverlaufs überhaupt ist. «Sobald das Vollbild einer Alzheimer-Erkrankung vorliegt, sind die statistisch beschriebenen Effekte für den Patienten und sein Umfeld zumeist nicht mehr wahrnehmbar», sagte Walter Schulz-Schaeffer vom Universitätsklinikum des Saarlandes in Homburg. «Dem müssen die Nebenwirkungen des Medikaments entgegengesetzt werden.»
Erwähnt wird im Fachjournal «The BMJ» zudem die in den Studien zu den Wirkstoffen gemachte Beobachtung, dass die Anti-Amyloid-Medikamente das Gehirn merklich schrumpfen lassen. Was es damit auf sich hat, ist bisher noch vollkommen unklar.