Heilen lässt sich Alzheimer nach wie vor nicht – bei einem sehr kleinen Teil der Betroffenen aber ein bisschen verzögern. Ein Antikörper kann künftig auch in Deutschland verwendet werden.
EU-Kommission lässt Wirkstoff Lecanemab gegen Alzheimer zu
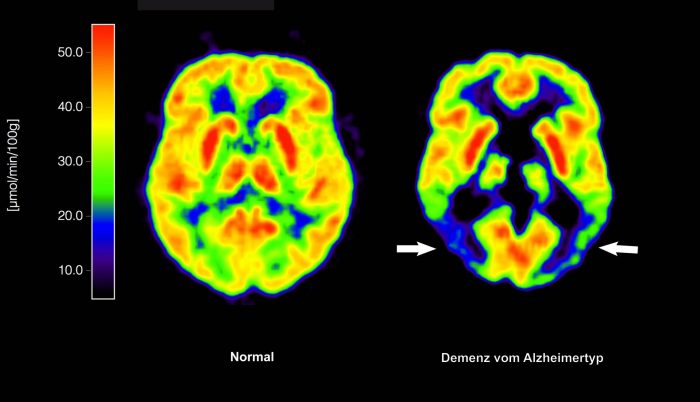
Die Europäische Kommission hat erstmals eine Alzheimer-Therapie zugelassen, die auf zugrundeliegende Krankheitsprozesse abzielt. Der Antikörper Lecanemab sei für eine Behandlung im frühen Stadium und das erste Medikament dieser Art, das in der EU zugelassen werde, teilte die Kommission mit. Fachleuten zufolge kommt nur ein sehr kleiner Teil der Alzheimer-Patienten für diese Therapie infrage.
Das Medikament, das möglicherweise in ein paar Monaten erhältlich sein wird, soll den Krankheitsverlauf etwas verlangsamen. Die Zulassung unterliegt strengen Auflagen laut EU-Kommission. Es wurde festgestellt, dass der Nutzen des Medikaments bei einer spezifischen Gruppe von Patienten und unter bestimmten Bedingungen die Risiken überwiegt.
Die Zulassung der Brüsseler Behörde erfolgte gemäß der Empfehlung der Europäischen Arzneimittel-Agentur (EMA). Bisherige Alzheimer-Therapien konzentrieren sich lediglich auf die Symptome der Krankheit und nicht auf die zugrundeliegenden Prozesse im Gehirn.
Beim Lecanemab ist dies anders: Der Antikörper zielt auf Amyloid-Ablagerungen im Gehirn ab und soll so den Krankheitsverlauf in einem frühen Stadium verlangsamen. Allerdings ist auch bei diesem Wirkstoff keine Heilung oder Verbesserung in Sicht.
Minimale Verzögerung
Der Hauptmaßstab für die Wirksamkeit der Therapie war die Veränderung der kognitiven und funktionellen Symptome nach 18 Monaten, die anhand einer von 0 bis 18 reichenden Demenzbewertungsskala gemessen wurde, wie es von der EMA hieß. Patienten, die mit Lecanemab behandelt wurden, zeigten im Durchschnitt einen etwas geringeren Anstieg des Wertes (1,22 gegenüber 1,75).
Fraglich ist Experten zufolge, wie alltagsrelevant diese leichte Verzögerung ist. «Sobald das Vollbild einer Alzheimer-Erkrankung vorliegt, sind die statistisch beschriebenen Effekte für den Patienten und sein Umfeld zumeist nicht mehr wahrnehmbar», sagte Walter Schulz-Schaeffer vom Universitätsklinikum des Saarlandes in Homburg.
Es wird laut Experten noch einige Monate dauern, bis das Mittel tatsächlich verwendet werden kann – unter anderem, weil der Hersteller verpflichtet wurde, ausführliche Handreichungen und Schulungen für Ärzte zu erstellen und ein Beobachtungsregister zu führen. Das Medikament wird alle zwei Wochen intravenös verabreicht.
Nur im Anfangsstadium einsetzbar
Lecanemab ist nur für die Behandlung von leichter kognitiver Beeinträchtigung (Gedächtnis- und Denkstörungen) oder leichter Demenz in einem frühen Stadium der Alzheimer-Krankheit zugelassen. Dies liegt daran, dass eine Entfernung der Amyloid-Plaques nichts mehr nützt, wenn diese bereits irreversible Schäden im Gehirn verursacht haben.
Zusätzlich gibt es eine weitere Beschränkung: Das Medikament soll ausschließlich bei Alzheimer-Patienten angewendet werden, die eine oder keine Kopie von ApoE4, einer spezifischen Form des Gens für das Protein Apolipoprotein E, besitzen. Bei diesen Personen ist das Risiko für bestimmte schwerwiegende Nebenwirkungen – wie Schwellungen und Blutungen im Gehirn – geringer im Vergleich zu Menschen mit zwei ApoE4-Kopien.
Nur für etwa jeden 60. Alzheimer-Kranken
Laut Experten des Deutschen Zentrums für Neurodegenerative Erkrankungen (DZNE) kommen von den geschätzten etwa 1,2 Millionen Alzheimer-Erkrankten in Deutschland nur sehr wenige für die neue Therapie in Frage. Die ersten drei Jahre gelten als frühe Phase – und somit als mögliche Phase für eine Antikörpertherapie. Dies betrifft derzeit schätzungsweise etwa 250.000 Menschen in Deutschland.
80 Prozent der Patienten, die mit ApoE4 in Betracht gezogen werden, erfüllen nicht alle Voraussetzungen für die Therapie und sind möglicherweise nicht daran interessiert. Experten schätzen, dass es konservativ etwa zehn Prozent sind. Insgesamt könnten das etwa 20.000 Patienten sein.
Der klinische Effekt bei Frauen ist jedoch noch deutlich geringer als bei Männern, ihr Risiko für Nebenwirkungen ist jedoch höher. Ob Frauen überhaupt von einer Behandlung profitieren, ist laut der Alzheimer Forschung Initiative noch unklar. Etwa zwei Drittel aller Alzheimer-Patienten sind weiblich.
Mangelnde Kapazitäten, hohe Kosten
Ausreichend Kapazitäten für die nun zugelassene Therapie gibt es bisher wohl nicht. «Ich gehe bei uns in Köln von um die 100 Patienten aus, die wir pro Jahr behandeln können. Und wir sind ein großes Zentrum», sagte der Neurologe Özgür Onur von der Uniklinik Köln.
Die Medikamentenkosten für Lecanemab in Europa sind ebenfalls unklar. In den USA belaufen sie sich auf etwa 26.500 US-Dollar (ca. 23.000 Euro) pro Patient und Jahr, wie Johannes Levin vom DZNE Ende letzten Jahres sagte. Zusätzlich gibt es einmalige Kosten für die Diagnostik in Höhe von geschätzten 1.400 bis 5.000 Euro. Die Kosten für die Verabreichung des Medikaments werden grob auf etwa 6.000 bis 8.000 Euro pro Jahr geschätzt, so der Experte. Lecanemab wird als intravenöse Infusion alle zwei Wochen verabreicht.
Nebenwirkungen müssen streng überwacht werden
Die Schwellungen und Mikroblutungen im Gehirn von Patienten, die in Studien erfasst wurden, verursachten meist keine Symptome und wurden häufig erst durch bildgebende Verfahren entdeckt. Jedoch können bei wiederholtem Auftreten eine verminderte Gehirnleistung oder Koordinationsprobleme auftreten. Mikroblutungen stellen auch ein Risiko für größere, potenziell lebensbedrohliche Hirnblutungen dar. Die meisten Alzheimer-Patienten sind über 80 Jahre alt, nur in wenigen Fällen beginnt die Krankheit vor dem 65. Lebensjahr.